Оптическая гистология неокрашенных тканей человека в режиме отражения (результаты)
Продолжение статьи о бесконтактной безмаркерной визуализации морфологии клеток человека с помощью аппарата в отражательном режиме
Исследование тканей человека
На рисунке 4 сравниваются три типа образцов, рассмотренных в данном исследовании. В качестве образцов для дистанционного фотоакустического зондирования использовались два микропрепарата, включая неокрашенные срезы, установленные на предметном стекле, и FFPE-блоки. Последовательные срезы ткани молочной железы были приготовлены в виде неокрашенных FFPE-блоков и неокрашенных срезов, установленных на предметном стекле, вместе со стандартным микропрепаратом, окрашенным Г&Э.
Чтобы приблизить поверхность объемной необработанной ткани, неокрашенные образцы, установленные на предметном стекле, не были защищены покровным стеклом. Образцы тканей представляли собой однородную контрольную мишень, позволяющую избежать артефактов при обработке изображения. FFPE-блоки наибольшим образом походили на мишени in situ, поскольку содержали ткани, которые могут быть захвачены только в отражательном режиме, и обеспечивали многослойную структуру для получения объемного изображения. Неокрашенные образцы визуализировались с помощью аппарата для дистанционного фотоакустического зондирования, продемонстрированного на рисунке 1, тогда как изображения ткани, окрашенной Г&Э, визуализировались с помощью стандартного патологоанатомического светлопольного микроскопа (Zeiss Axioscope 2 с Zeiss Axiocam HR).
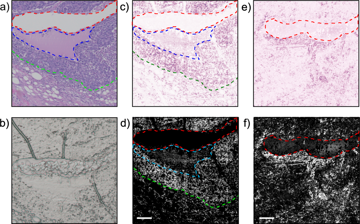
Эффективность дистанционного фотоакустического зондирования для визуализации структур клеточного масштаба сравнивается со стандартной микроскопией с использованием препаратов, окрашенных Г&Э, на примере тканей молочной железы (рисунок 5), желудочно-кишечного тракта (рисунок 6) и миндалин (рисунок 7). Для прямого сравнения аналогичные области визуализированы в случае со всеми тремя образцами.
Рисунок 4. Сравнение трех типов образцов: (слева) фиксированный формалином блок ткани, залитый парафином; (посередине) стандартный микропрепарат, окрашенный Г&Э; (справа) неокрашенный микропрепарат
Рисунок 5. Сравнение изображений, полученных с помощью дистанционного фотоакустического зондирования, и (а) светлопольных изображений одного и того же образца ткани молочной железы с инвазивной протоковой карциномой. (b) Неокрашенный срез, визуализированный с помощью стандартного светлопольного микроскопа, с нанесенной (c) картой условных цветов Г&Э и (d) логарифмической цветовой картой в режиме «серой шкалы». Визуализация FFPE-блока с помощью дистанционного фотоакустического зондирования с наложением (e) карты условных цветов Г&Э и (f) логарифмической цветовой карты в режиме «серой шкалы».
Рисунок 6. (а) Стандартный образец, окрашенный Г&Э и визуализированный с помощью микроскопии кровеносного сосуда (в пределах зеленого контура), расположенного в ткани поджелудочной железы, окруженного мышечным слоем (между зеленым и желтым контуром) с гладкомышечными клетками. (b) Неокрашенный микропрепарат, содержащий последовательный срез, визуализированный с помощью дистанционного фотоакустического зондирования. (c) Прямое наложение изображений (a,b).
Рисунок 7. (а) Сканирование образца ткани миндалины с большим полем обзора с помощью дистанционного фотоакустического зондирования. (b) Увеличенное изображение с высоким разрешением края кожи, поверхностного гиперклеточного многослойного плоского эпителия (желтый контур) и четкого разграничения с нижней гиперклеточной стромой (зеленый контур), полученное с помощью дистанционного фотоакустического зондирования. (c) Окрашенный микропрепарат, содержащий последовательный срез с ткани миндалины
Рисунок 5а представляет собой изображение стандартного образца, окрашенного Г&Э, полученное с помощью светлопольного микроскопа при 5-кратном увеличении. Для сравнения неокрашенные срезы ткани также были визуализированы с помощью светлопольного микроскопа (рисунок 5b). Светлопольные изображения (рисунки 6а, 7с) получены при увеличении 10x и 20x соответственно. Каждое изображение сравнивалось с изображением последовательных окрашенных срезов. В том числе, на рисунке 7a продемонстрированы возможности системы получения изображений с большим полем обзора (1 см x 1 см).
Объемное сканирование тканей
Было выполнено объемное сканирование FFPE-блоков для получения изображения нескольких клеточных слоев (рисунок 8). Объемное сканирование осуществлялось путем получения изображений на 100 уровнях глубины образца с шагом 500 нм с помощью дистанционного фотоакустического зондирования. Для получения объемного изображения на рисунке 8 общее время сканирования составило около 33 минут, скорость сбора данных составила около 360 мкм3/с. Несколько отдельных клеточных слоев были визуализированы на различной глубине образца, а клеточное разрешение поддерживалось на глубине ~ 50 мкм.
Рисунок 8. Объемное сканирование опухолевой ткани молочной железы (инвазивная протоковая карцинома) (а) Последовательные срезы на расстоянии 7 мкм друг от друга. (b) Срезы, продемонстрированные на рисунке (a).
Обсуждение
Система, представленная в статье, обладает важными характеристиками, необходимыми для гистологической визуализации тканей. Дистанционное фотоакустическое зондирование не требует добавления дополнительного контраста к образцу, неокрашенные микропрепараты обеспечивают приемлемый аналог приготовленных без контраста образцов и образцов, окрашенных Г&Э. Контраст на изображениях, полученных с помощью дистанционного фотоакустического зондирования, обеспечивается пиком поглощения образца на 266 нм, который в первую очередь обозначает концентрацию ДНК. Однако другие окружающие вещества, такие как в частности цитохром, гемоглобин и коллаген, вероятно, в некоторой степени влияют на сигнал, поскольку демонстрируют ненулевое поглощение на 266 нм.
Высокая концентрация ДНК в клеточных ядрах облегчает визуализацию морфологии и плотности ядра и распределения клеток, так как сигнал дистанционного фотоакустического зондирования пропорционален оптическому поглощению, которое, в свою очередь, пропорционально концентрации хромофора. Контраст на срезах, окрашенных Г&Э, наблюдается между клеточными ядрами (фиолетовыми) и окружающей цитоплазмой (розовыми) (рисунки 5a, 6a, 7c). Краситель гематоксилин в основном используется для ядерного окрашивания, тогда как эозин используется для визуализации цитоплазмы.
В данном исследовании изображения, полученные с помощью дистанционного фотоакустического зондирования, демонстрируют контраст как при окрашивании гематоксилином, поскольку длина волны 266 нм поглощается ДНК в ядрах клеток. Такой же контраст получается в случае с микропрепаратом, окрашенным Г&Э, где интенсивность окрашивания гематоксилином пропорциональна концентрации отрицательных ионов, присутствующих в ДНК и РНК. Возможность визуализировать толстые ткани с сильным поглощением ДНК на 266 нм также позволит визуализировать свежерезецированную ткань. Поскольку ДНК поглощает длину волны 266 нм значительно больше, чем гемоглобин и другие хромофоры, доминирующий контраст по-прежнему будет исходить от ДНК, что облегчает визуализацию краев резекции и клеточной морфологии. Аналогичным образом, результаты данного исследования также могут быть применены к какой-либо из полостей организма после резекции. Изображения неокрашенных микропрепаратов, полученные с помощью дистанционного фотоакустического зондирования, подчеркивают характерные особенности образца, включая области гиперцеллюлярности и четкие границы между различными типами тканей.
В будущем потребуется метод для получения изображений цитоплазмы, окрашенной красителем, аналогичным эозину, когда совместная визуализация обеспечивала бы двойной контрастный сигнал. При дистанционном фотоакустическом зондировании можно выбрать иные длины волн возбуждающего излучения для получения контраста, обеспечиваемого дополнительными хромофорами, которые окрашивают различные компоненты ткани.
Эксперименты с объемной визуализацией (рисунок 8) подчеркивают эффективность устройства для измерений образцов толстых тканей. В ходе исследования была выполнена визуализация нескольких клеточных слоев в диапазоне глубины образца 50 мкм, что является пределом для данной оптической системы при измерении FFPE-блоков. Дистанционное фотоакустическое зондирование ранее продемонстрировало способность превышать среднюю длину свободного пробега возбуждающего излучения в тканях благодаря более глубоко проникающему зондирующему пучку, что может свидетельствовать о взаимодействии между источником излучения 1310 нм и парафиновой средой FFPE-блоков. В будущем, возможно, потребуется исследовать другие диапазоны источника излучения для получения изображений таких образцов.
Используемые методы качественного анализа могут обеспечить получение дополнительных показателей в ходе компьютерной диагностики на основе дистанционного фотоакустического зондирования, что необходимо для соответствия общепринятому стандартному методу распознавания образов человеком. Это имеет решающее значение для идентификации и начальной диагностики тканей.
Выводы
В данной работе были сделаны предварительные шаги к разработке метода визуализации in situ. Бесконтактный метод позволяет избежать дополнительных осложнений, таких как повышенный риск инфицирования, и избежать дорогостоящего процесса до- и послеоперационной стерилизации. Кроме того, оптический бесконтактный механизм обнаружения позволяет визуализировать контраст поглощения без использования громоздкого ультразвукового преобразователя, исключающего клиническое использование в ограниченном рабочем пространстве. Это может позволить в будущем разработать интраоперационный хирургический микроскоп, работающий в режиме реального времени.
Оптическая архитектура системы также обеспечивает простую интеграцию с дополнительными методами визуализации, такими как оптическая когерентная томография, флуоресцентная микроскопия и т.д. благодаря отсутствию ультразвукового преобразователя и среды распространения ультразвуковых колебаний.
В работе предлагается технология производства источников неразличимых фотонов в телекоммуникационном С-диапазоне на основе эпитаксиальных полупроводниковых квантовых точек. Новая методика позволяет детерминировано интегрировать квантовые излучатели в микрорезонаторы из кольцевых брэгговских решёток.
контакты
г. Санкт-Петербург, улица Савушкина 83, корп. 3