Автофлуоресцентная микроскопия
Введение
Распространенным методом обнаружения микробов в жидких и нежидких образцах является окрашивание флуоресцентными красителями, при котором образцы окрашиваются флуорофором, возбуждаемым фотонами от источника света. Часть энергии этих фотонов переизлучается в виде света с большей длиной волны — это свойство известно, как флуоресценция. Флуорофоры — это молекулы, которые проявляют флуоресценцию, и могут быть биомолекулами естественного происхождения (в этом случае флуоресценция называется автофлуоресценцией), флуоресцентными красителями (синтезированными молекулами) или минералами. Некоторые красители обладают значительной флуоресценцией при УФ-возбуждении и легко связываются с преобладающим типом биомолекул (часто ДНК или РНК), позволяя "окрашивать" клетки. Такие красители, как акридиновый оранжевый (АО), флуоресцентный краситель DAPI, тетраметил-родамин-этил-эфир (TMRE), флуоресцеин-изотиоцианат (FITC), FM143 и цианодитолил-тетразолий хлорид (CTC) используются для обнаружения и/или перечисления микроорганизмов в жидких и нежидких образцах. Эти красители без разбора связываются с нуклеиновыми кислотами и/или мембранными белками, что делает их пригодными для отличия живых организмов от окружающей среды. Аминокислоты, включая триптофан, тирозин и фенилаланин, обладают автофлуоресценцией, полезной для визуализации клеток, но не связываются с биомолекулами, как это делают красители. Конкретные применения красителей включают обнаружение и перечисление бактерий, визуализацию экспрессии генов и обнаружение биомолекул, которые иначе невозможно было бы отследить. Несмотря на свою универсальность и надежность, флуоресцентные красители могут быть токсичными для клеток и изменять поведение микроорганизмов, что ограничивает биомедицинское применение традиционных красителей для визуализации. Красители используются в приложениях in situ из-за высокого соотношения сигнал/шум, которое они могут обеспечить, но часто освещают более широкий спектр молекул, чем требуется, что затрудняет идентификацию микроорганизмов. Фотообесцвечивание (необратимые химические изменения в биомолекулах, вызванные взаимодействием с фотонами высокой энергии) также ограничивает применимость и эффективность красителей и возбуждения флуорофоров в целом.
Доступные и надежные методы визуализации in situ без меток востребованы в микробиологических исследованиях и даже применимы в точечной диагностике (point-of-care diagnostics) и биомедицинских исследованиях. Хотя распространенные биотические флуорофоры, за исключением хлорофилла, менее флуоресцентны, чем флуоресцентные красители, слабые сигналы флуоресценции можно отличить от шума при длительной экспозиции камеры и определенных длинах волн возбуждения. Из-за того, что хлорофилл присутствует почти исключительно в фотосинтезирующих организмах, он не является надежным маркером для визуализации in situ, учитывая огромное разнообразие микробной жизни. Вместо этого, NADH (никотинамидадениндинуклеотид) и триптофан являются одними из наиболее постоянно используемых флуорофоров природного происхождения для визуализации. Благодаря широкому спектру излучения (420 - 550 нм) и роли в клеточном метаболизме, NADH позволяет косвенно оценить метаболическую активность клеток, но его автофлуоресценция сталкивается с помехами от биомолекул, таких как FAD+ (флавин-адениндинуклеотид) и автофлуоресценция минералов. Триптофан вместе с аминокислотами, такими как фенилаланин, проявляет автофлуоресценцию при глубоком УФ-возбуждении. Традиционная визуализация аминокислот, как правило, сталкивается с меньшими помехами, чем визуализация NADH, поскольку пик автофлуоресценции NADH и минералов находится в зеленом диапазоне (495 - 570 нм). Однако из-за низкой концентрации триптофана по сравнению с обычными биомолекулами (например, NADH, глюкозой) в клетках, его обычно приходится вводить в клетки через какой-либо субстрат. Такое введение является химической манипуляцией, которая нарушает поведение микроорганизмов и не является идеальной для визуализации in situ.
Исключение метода использования красителей для флуоресцентной визуализации сводит к минимуму химические манипуляции с образцами, что минимизирует необратимое повреждение образца. Многие альтернативные методы визуализации, включая рамановскую спектроскопию, многофотонную флуоресцентную визуализацию и визуализацию времени жизни флуоресценции, показали перспективность в микробиологии. Тем не менее, традиционная визуализация с помощью флуоресцентных красителей остается наиболее популярной (особенно для обнаружения микроорганизмов в абиотических средах) из-за ее известности, масштабируемости, низкой стоимости и наличия сигналов флуоресценции, которые легче изолировать, чем сигналы автофлуоресценции без меток. Несмотря на многочисленные попытки перенести безметочную визуализацию на недорогие устройства, связанные со смартфонами, такие как "Pocket MUSE", надежное обнаружение микробов с помощью этих устройств, без добавления красителей и/или модификации устройств для повышения чувствительности к свету по сравнению с заводскими условиями, оказалось сложной задачей. "Pocket MUSE" был прототипом, предназначенным для получения изображений Eukarya и больших бактериальных колоний в видимом спектре при малом увеличении (например, 10x), которые включают некоторое излучение от УФ-возбуждения, с помощью пользовательского компонента и держателя образца, установленного на задней камере смартфона. Он задумывался как инструмент для научного образования, который будет работать с различными типами образцов, а не как серьезный исследовательский инструмент. Его минимальная длина волны возбуждения 285 нм ограничивает его способность давать изображения для образцов горных пород или жидких образцов с высокой концентрацией минералов и ограничивает диапазон флуорофоров, которые он может возбуждать.
Существующие исследования по визуализации без меток сосредоточены на просмотре узких диапазонов излучения, и редко исследуют многополосную визуализацию. Ограничения видимости микробов на флуоресцентных изображениях без меток включают длину волны возбуждения, разрешение фотографии (на которое влияет как разрешение камеры, так и эффективное разрешение объективов) и флуорофоры, присущие рассматриваемому образцу. Получение изображений без меток осложняется слабым флуоресцентным сигналом большинства биомолекул по сравнению с красителями и тем фактом, что концентрация молекул красителя может значительно превышать концентрацию естественных биотических флуорофоров. Красители обычно излучают больше флуоресценции, чем природные флуорофоры, поскольку они нацелены на молекулы, которые повсеместно распространены (например, ДНК) и специально разработаны и/или отобраны для получения сильных сигналов. Поскольку обычные флуоресцентные красители без разбора нацелены на тип биомолекул (например, нуклеиновые кислоты), а не на конкретную биомолекулу, для получения изображений конкретных биомолекул необходимы другие методы. Исследователи, испытавшие маломолекулярный фолат-триггерный ДНК-аппарат, создали G-квадруплексную последовательность ДНК, которая взаимодействовала с N-метилмезопорфирином IX, флуорофором естественного происхождения, создавая безметочный флуоресцентный сигнал с силой, пропорциональной концентрации фолата в образце человеческой сыворотки. Самая низкая концентрация фолата, обнаруженная этим методом, составила 0.23 пМ.
Длины волн возбуждения, используемые при флуоресцентной визуализации, значительно влияют на наблюдаемость микробов в полученных изображениях. Многочисленные исследования показали, что возбуждение в диапазоне 200 - 280 нм (глубокий ультрафиолет (DUV)) является наиболее подходящим для высококонтрастной флуоресцентной визуализации благодаря избирательному возбуждению биомолекул, а не минералов. Для визуализации сигналов автофлуоресценции возбуждение DUV может быть предпочтительным, поскольку флуоресценция минералов при DUV минимальна по сравнению с другими флуорофорами. Однако глубокий УФ-диапазон гораздо менее исследован, чем ближний ультрафиолетовый (NUV) диапазон 260 – 365 нм и видимый диапазон (380 - 700 нм). Исследований по многодиапазонной визуализации мало, в основном из-за узких диапазонов автофлуоресценции флуорофоров (особенно распространенных биомолекул) и сложностей с необходимым оборудованием (например, несколькими камерами).
Интенсивность автофлуоресценции триптофана при глубоком УФ-возбуждении прямо пропорциональна интенсивности возбуждения при данной длине волны возбуждения. В одном из исследований, изучавших автофлуоресценцию триптофана при глубоком УФ-возбуждении, было обнаружено, что интенсивность автофлуоресценции значительно возрастает при увеличении концентрации триптофана, а в клинико-биологическом исследовании было уточнено, что триптофан, встречающийся в природе в различных бактериях, обеспечивает узкое, но различимое "спектральное окно" при возбуждении на длине волны от 340 нм при 280 нм. Для создания профиля флуоресцентных сигналов, полученных от широкого разнообразия патогенных и клинически значимых штаммов бактерий, девять штаммов инкубировали в жидкой питательной среде при 180 об/мин, наряду с двумя штаммами Clostridium difficile, выращенными в бульоне с сердечно-мозговым экстрактом (BHI). Затем характеристики флуоресценции жидких и твердых образцов поверхности каждого штамма были измерены с помощью флуоресцентного спектрометра PerkinElmer LS55. Обнаруженные длины волн эмиссии для каждого образца были построены против длин волн возбуждения на матрице возбуждения-эмиссии (EEM). EEM образцов твердой поверхности и жидких образцов одного и того же штамма были усреднены, чтобы учесть типичный уровень автофлуоресценции минералов, присутствующий на поверхностях в больничных условиях. Тщательный анализ EEM показал, что триптофан был единственным значимым флуорофором для всех штаммов, демонстрируя пик эмиссии около 340 нм, что позволило исследователям утверждать, что это лучший флуорофор для обнаружения бактерий с помощью устройства мониторинга клинического загрязнения. У Pseudomonas наблюдался значительный эмиссионный пик 455 нм от сидерофора пиовердина. В то время как на металлических и пластиковых поверхностях, таких как компьютерные клавиатуры, многочисленные устройства не показали значительных помех для эмиссии триптофана бактериями, чистящая салфетка из микрофибры значительно мешала пику триптофана с длиной волны 340 нм. Однако флуоресцентная сигнатура Pseudomonas aeruginosa появлялась в полосе, которая не мешала флуоресценции ткани, и исследователи предположили, что можно разработать алгоритмы машинного зрения, чтобы отличить форму ткани от аморфных бактерий.
Доставка триптофана в клетки рода Candida albicans с помощью серебряных наночастиц увеличивала интенсивность автофлуоресценции при использовании синхротронного пучка 290 нм. Поскольку интенсивность автофлуоресценции наночастиц триптофан-Ag значительно варьировалась в зависимости от химического окружения конкретных участков клеток, можно было определить области накопления наночастиц и, таким образом, происхождение флуоресцирующего триптофана внутри клеток. Средняя интенсивность автофлуоресценции в клетках, инкубированных с этими наночастицами, снижалась с большей скоростью, чем в неинкубированных, вследствие фотообесцвечивания. Скорость фотообесцвечивания, измеренная в определенных областях клеток C. albicans, коррелировала с полярностью этих областей.
Исследователи, визуализирующие микроорганизмы в толще земного льда, добились детального обнаружения микробных распределений путем картирования сигнатур автофлуоресценции DUV их органических соединений. Один прибор для картирования DUV-излучения, использующий инструмент Wire Analysis Tool for the Subsurface Observation of Northern ice sheets (WATSON), может проникать до 10 мм в прозрачный и непрозрачный лед с помощью глубокого УФ-лазера и обнаруживать до 125 (±32 клеток) за один лазерный импульс. Возможности WATSON можно перенести на разработку приборов для анализа внеземного льда. Исследования спектрометров для картирования глубокой УФ-флуоресценции позволили выделить сигналы автофлуоресценции, которые соответствуют сигнатурам различных органических молекул. Исследователи WATSON выбрали для прибора лазер с возбуждением 248.6 нм из-за эффективности этой длины волны для возбуждения молекул, содержащих ароматические кольца в микроорганизмах, которые производят значительную эмиссию флуоресценции в диапазоне 275 - 450 нм.
Марсоход NASA Perseverance, высаженный на Марс в феврале 2021 года, является первым марсоходом, использующим DUV-флуоресценцию для получения изображений марсианской поверхности. На марсоходе установлена камера WATSON для получения макрофотографических изображений в видимом свете, предоставляющих информацию о геометрии горных пород. Прибор SHERLOC выполняет одновременную флуоресцентно-рамановскую спектроскопию DUV с помощью лазера с полым катодом NeCu с длиной волны 248.6 нм, произведенного компанией Photon Systems, Inc. Эта длина волны позволяет разделять спектры флуоресценции и рамановского излучения, снимаемые импульсами 9 мкДж, интенсивность которых регулируется PWM 20-40 мкс (широтно-импульсная модуляция). SHERLOC интерпретирует рамановский спектр, используя испущенные рамановские фотоны на каждом пикселе, и спектр флуоресценции для каждого пикселя для создания составного изображения. SHERLOC может обнаруживать фотоны флуоресценции 270 - 370 нм от органических молекул. Каждая спектральная карта SHERLOC обеспечивает пространственное распределение минерального и органического состава, который SHERLOC затем соотносит с морфологическими особенностями на изображениях WATSON и серошкальной камеры ACI. Такое сопоставление данных изображений позволяет провести детальный анализ минерального и органического состава образцов марсианской поверхности.
Бурильный DUV-спектрометр, развернутый на ледяном покрове Гренландии в 2020 году, исследовал многочисленные области, содержащие органические вещества, на глубине от 0 до 105 м во льду. Спектрометр продемонстрировал способность обеспечить детальное изображение очагов микробной жизни радиусом <20 мм в подповерхностном льду. Такое детальное отображение стало возможным благодаря отказу от традиционного метода исследования льда после его таяния. В исследовании использовался тот же лазер с длиной волны 248.6 нм, что и в SHERLOC, который был оптимизирован для возбуждения ароматических органических молекул как признаков органического материала. Исследователи не обнаружили признаков флуоресцентных горячих точек, которые были бы вертикально слоистыми во льду, а большинство найденных точек составляли 2 - 4 мм независимо от глубины скважины.
Одной из альтернатив флуоресцентной визуализации с глубоким УФ-возбуждением является рамановская визуализация, которая использует рамановское рассеяние для генерации фотонов с энергией, несущей информацию о химическом составе и молекулярной структуре в целевых точках образца. Рамановское рассеяние происходит, когда падающий фотон имеет энергию и угол падения такие, что при ударе о молекулярную связь он вызывает полярность (диполь) в связи. Эта индуцированная полярность немедленно выравнивается, испуская фотон, который называется рамановским рассеянным фотоном, если он имеет меньшую энергию, чем падающий фотон. В спектрометрах комбинационного рассеяния обычно используется возбуждение в ближнем ИК-диапазоне (785 - 1064 нм), чтобы минимизировать фотоны флуоресценции, которые будут мешать фотонам комбинационного рассеяния - интересующему сигналу. NIR (ближняя ИК-область спектра) — возбуждение устраняет возбуждение флуоресценции для большинства минералов, но все еще будет возбуждать любые минералы, уже находящиеся в возбужденных электронных состояниях при энергии фотонов NIR. NIR создает неоптимальное соотношение рассеянных рамановских фотонов к падающим фотонам, что приводит к низкой эффективности визуализации. Рамановская визуализация с DUV-возбуждением (в частности, <250 нм) может обеспечить в 100 раз больший выход рамановских фотонов, чем при NIR-возбуждении, и позволяет разделить полосы рамановского излучения и флуоресценции. Некоторые материалы, такие как алмаз, имеют полосы электронного резонанса, которые перекрываются с длинами волн DUV, что еще больше усиливает рамановский сигнал. Такой резонанс существует для биологических молекул, включая пиримидины, тирозин, фенилаланин и триптофан, что делает рамановское излучение DUV оптимальным для просмотра рамановских сигналов микроорганизмов. Одно из исследований высушенных бактерий на пластинах из плавленого кварца, включая колонии Micrococcus, Bacillus, E. Coli и Staphylococcus, показало, что идентификация штаммов с помощью DUV комбинационного рассеяния света с точностью 99%.
Рамановская спектроскопия с временным разрешением в DUV последовательно использовалась для изображения молекулярной динамики биомолекул, в которых рамановский сигнал может быть резонансно усилен. Исследование, в котором были измерены рамановские спектры триптофана и тирозина с помощью рамановского импульса 220 нм, показало, что рамановские пики согласуются с теми, которые были обнаружены ранее для аналогичных типов биомолекул в резонансной рамановской спектроскопии. Эти исследователи продемонстрировали рудиментарный метод визуализации конформационных изменений белков, происходящих в фемтосекундном масштабе времени. Более того, пики рамановского резонанса биомолекул, возникающие в том же диапазоне глубокого УФ-возбуждения, могут быть использованы для идентификации бактерий внутри колоний. Пики рамановского резонанса ДНК/РНК коррелируют с соотношением гуанин/цитозин, что дает достаточно информации для генотаксономической классификации.
Другой метод получения флуоресцентных сигналов от образцов — это маркировка образцов квантовыми точками. Квантовые точки — это полупроводниковые частицы (обычно ионные соединения), которые при УФ-возбуждении проявляют флуоресценцию на постоянной длине волны, что делает их ценными инструментами для визуализации. Группа исследователей, добавившая квантовые точки ZnS и CdSe к бактериальной культуре (путем конъюгирования квантовых точек с полимиксином B), обнаружила, что QD-полимиксин B эффективно маркирует грамотрицательные бактерии. Для визуализации использовалась ртутная лампа, обеспечивающая широкополосное синее возбуждение, в комбинации с 100-кратным масляным объективом. Результаты исследования показали, что биоконъюгат QD-PMB имеет потенциальное применение в качестве наночастичного зонда для идентификации патогенов. Более того, хотя высокоспецифичная по длине волны флуоресценция квантовых точек делает их полезными для маркировки клеток, их способность претерпевать окислительно-восстановительные реакции с биомолекулами явно вызывает изменения в эмиссионных спектрах и клеточных процессах, которые мало изучены. Эти взаимодействия включают образование реактивных форм кислорода в результате столкновений фотонов с квантовыми точками, одна из форм фототоксичности.
Исследователи признали, что сильное флуоресцентное излучение и способность квантовых точек к сцеплению делают их универсальными инструментами визуализации, в том числе для обнаружения патогенных бактерий и индукции летальных процессов в раковых клетках. Биотехнологи NIH(Национальный Центр Исследования Здоровья) протестировали метод одновременной идентификации нескольких патогенов, включающий конъюгацию квантовых точек с одним типом бактериофага. Их покрытые стрептавидином квантовые точки CdSe были конъюгированы с бактериофагами, которые заражали несколько штаммов, просматриваемых на микроскопе Olympus Vanox-T. Распространение Phage-QD через образцы просматривалось и количественно оценивалось с помощью низкоинтенсивного возбуждения 447 нм. После 1 часа применения этого метода к образцу воды объемом 1 мл, они определили, что в нем присутствовало не менее 20 кишечных палочек, поскольку заявленный предел обнаружения составлял 10 клеток на 1 мл. Предложения после проведенного эксперимента включают расширение метода на несколько специфических штаммов, конъюгированных с квантовыми точками разного цвета, разработку портативных приборов с Phage-QD детектором и использование метода в качестве общего инструмента для исследований фаговой биологии.
Получение флуоресцентных изображений, точно регистрирующих биохимические параметры, такие как концентрация, pH и давление газа, осложняется различиями в интенсивности излучения флуорофоров при разных длинах волн и неоднородным распределением флуорофоров. Визуализация времени жизни флуоресценции (FLIM) измеряет количество времени, в течение которого возбужденный флуорофор остается в возбужденном состоянии до начала флуоресценции (время жизни флуоресценции), в отличие от традиционной визуализации флуоресценции, которая исследует только интенсивность и распределение флуорофоров. Большинство приборов FLIM используют быстрые лазерные импульсы от перестраиваемого ИК-двухфотонного лазера (субнаносекундная длительность импульса) и измеряют время затухания эмиссии для определения времени жизни флуоресценции. В мета-анализе FLIM в медицине упоминается, что возможность высокой скорости обнаружения, особенно для FLIM, основанного на частотной области, и способность чувствовать быстрые изменения физиологических параметров в образце делают его универсальным инструментом визуализации. Биомедицинские применения FLIM включают многофотонное возбуждение FLIM для диагностики состояния кожи (поскольку он может проникать в кожу человека на ≈ 200 мкм глубже, чем однофотонный FLIM), обнаружение раковых клеток при множественных раковых заболеваниях из-за более короткого времени жизни флуоресценции флуорофора, называемого производным гематопорфирина (HpD), в злокачественных клетках по сравнению с нормальными клетками, отображение различий в биохимической активности нейронов для помощи в нейрохирургии, а также визуализация in vivo микросреды человеческого органа, например, печени.
В данном исследовании объединены методы DUV, NUV и визуализации флуоресцентных красителей в видимом свете и предложена многодиапазонная модульная микроскопическая установка для визуализации бактериальных клеток на эндолитных образцах. Конкретный выбор эндолитных образцов позволяет расширить методы флуоресцентной визуализации, традиционно используемые для жидких образцов, и получить данные о свойствах флуорофоров, которые имеют отношение к астробиологии и биомедицинским исследованиям. Анализируемые образцы представляют собой фрагменты гипса и мрамора с местными цианобактериями, каждый из которых инокулирован B. subtilis, окрашенным одним из трех флуоресцентных красителей: SYTO 9, Acridine Orange или FM-143.
Методы исследования
Экспериментальная установка и характеристика
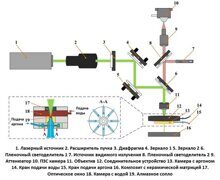
В системе DUV, используемой в данном исследовании, применяется модульный каркас микроскопа (Thorlabs Cerna с эпи-иллюминацией). Корпус микроскопа (CEA1350) соединен с источником освещения с согласующей оптикой, одним кубическим фильтром, тубусным объективом и камерой, а также объективом (рис. 1). Для возбуждения DUV и эмиссии от ближнего ультрафиолета до видимого диапазона не требуется никаких специальных оптических компонентов, кроме источника освещения. Для регистрации УФ-излучения линза объектива, объектив камеры Рэле и камера должны быть совместимы с УФ-излучением (кварцевая конструкция). Образцы горных пород, содержащие как нефотосинтетические бактерии без значительной собственной автофлуоресценции (Bacillus subtilis), так и местные цианобактерии (с присущей автофлуоресценцией хлорофилла).
Для возбуждения использовались светодиоды, включая DUV (275 нм, минимум 45 мВт, Thorlabs M275L4), NUV (365 нм, минимум 1350 мВт, Thorlabs M365LP1) и видимые (450 нм, минимум 2118,1 мВт, Thorlabs M450LP2). Излучение светодиодов характеризовалось с помощью высокочувствительного спектрофотометра УФ-видимого диапазона. Наборы фильтров были приобретены у компании Chroma, предварительно смонтированы в совместимые с Olympus кубики фильтров и модифицированы совместимыми фильтрами, приобретенными у Edmund optics и Chroma. Все фильтры имели минимальную оптическую плотность 6. Для видимого возбуждения и эмиссии использовался аураминовый длинноволновый фильтр (450/50; 485 нм дихроичный; 495 нм длинноволновый эмиссионный). Для возбуждения в ближнем ультрафиолете и видимого излучения использовался фильтр DAPI longpass (400 нм), соединенный с пользовательским фильтром возбуждения и дихроичным фильтром (375/25; 400 нм longpass dichroic). NUV (365 нм) и видимые (450 нм) светодиоды были прикреплены к кронштейну объектива, соединенному сбоку с кубом фильтра, перпендикулярно коллиматору. Из-за низкой мощности светодиода DUV он не был подключен к кубу фильтра, а непосредственно освещал образец на расстоянии ≈ 10° над плоскостью предметного столика, как показано на рис. 1. Светодиод использовался с полосовым возбуждающим фильтром 275/20 нм и длинноволновым дихроичным фильтром 280 нм. Затем использовались фильтры с полосой пропускания 320/20 нм, 357/44 нм и 400 нм для регистрации глубокого УФ, ближнего УФ и видимого излучения, соответственно.
Рисунок 1. Схема модульного микроскопа Thorlabs/Cerna, созданного для данного проекта. Контроллер для Thorlabs KURIOS-WB1 (второй элемент сверху микроскопа) не показан.
Полные спектры видимого излучения были получены с помощью многоспектрального жидкокристаллического перестраиваемого фильтра Kurios (Thorlabs KURIOS-WB1, 420-730 нм, 35 нм полная ширина полумаксимума). Если не указано иное, для всех изображений видимого излучения использовалась камера Zyla 4.2 sCMOS производства Andor (Oxford Instruments). Фильтр был запрограммирован на срабатывание при получении изображения Andor с помощью функции "trigger out" на камере Andor с кабелем BNC-to-HDB15 (Hosa Technology RGB-506). Для NUV и видимого возбуждения использовался шаг в 2 нм от 420 и 490 нм соответственно для всего диапазона 730 нм. Размер шага возбуждения DUV был увеличен до 15 нм из-за увеличения времени экспозиции и минимизации фотообесцвечивания. Изображения были получены с помощью программного обеспечения Micromanager 2.0, а полученные стеки изображений были проанализированы в программе Fiji. Изображения HDR с подсветкой генерировались в Scyven (Scyllarus, Канберра, Австралия), и спектры отдельных пикселей сравнивались с контрольными спектрами триптофана (Alfa Aesar, Thermo Fisher, Haverhill), тирозина (Alfa Aesar), фенилаланина (Acros Organics, Thermo Fisher, Geel), окрашенных B. subtilis и E. gracilis для идентификации.
Красители и химические вещества
Если не указано иное, использовались красители и культуральные производства компании Fisher Scientific.
Подготовка образцов
Исследуемыми организмами были Bacillus subtilis (B. subtilis ATTC 6051, приобретенная у American Type Culture Collection), Saccharomyces cervisiae или пекарские дрожжи (Red Star Organic Yeast), Euglena gracilis (Carolina Biological Supply) и местные эндолитические сообщества Chroococcidiopsis, присутствующие в образцах гипса и мрамора (Henry Sun, Desert Research Institute). Мрамор представляет собой непрозрачное белое кристаллическое вещество с вкраплениями зеленого цвета. Гипс представляет собой непрозрачное пористое твердое вещество с небольшими очагами зеленого цвета. Культуры B. subtilis содержались в лизогенном бульоне (Fisher BioReagents) и инкубировались при 37 °C в течение 18-24 часов. Эвглена содержалась в среде, состоящей из 12 семян пшеницы, риса, одного гороха и 2.5 г сухого молока; они хранились при комнатной температуре при умеренном освещении. S. cervisiae выращивали в течение 30 минут, используя соотношение 3.5 г сахара, 30 мл воды, 4.5 г дрожжей при 43 °C.
К B. subtilis добавляли флуоресцентные красители в следующих конечных концентрациях: 1 мкг/мл Fm1-43, 1 мкМ AO, 1 мкМ SYTO9 (Invitrogen). S. cervisiae окрашивали Calcofluor White в конечной концентрации 20 мкМ. Гипсовые и мраморные породы измельчали до такого размера, чтобы фрагменты помещались на стеклянные предметные стекла микроскопа, используемые с микроскопической установкой. Все образцы промывали как минимум дважды до и после окрашивания. Жизнеспособность клеток и окрашивание подтверждали на стандартной установке конфокального микроскопа (Olympus) при возбуждении ртутной лампой. Если не указано иное, всем образцам давали полностью высохнуть на эндолите перед визуализацией. Спектры поглощения нескольких флуорофоров были получены с помощью программы Clariostar.
Рисунок 2. Спектры поглощения распространенных красителей, показывающие общий второй пик в области DUV и, за исключением калькофлюора белого, отсутствие возбуждения в области NUV.
Результаты
Восемь образцов горных пород были сфотографированы на специализированном микроскопе Thorlabs/Cerna под источниками возбуждения видимого света, NUV и DUV с использованием камеры Andor, при этом на каждый образец было получено от одного до двух многополосных флуоресцентных изображений для каждого источника возбуждения. Эти многоспектральные изображения, охватывающие 420 - 730 нм для NUV и DUV изображений и 450 - 730 нм для изображений в видимом свете, были объединены в окрашенные изображения, содержащие средние спектры флуоресценции на каждом пикселе (осветители). Цвет каждого пикселя представляет собой длину волны средней интенсивности для спектра флуоресценции в этом пикселе. Все образцы, окрашенные SYTO9, FM-143 или акридиновым оранжевым, имели NUV многополосные изображения, показывающие автофлуоресценцию минералов, причем флуоресценция красителя редко поднималась выше уровня шума. Автофлуоресценция хлорофилла от местных Chroococcidiopsis присутствовала во всех образцах гипса и мрамора, но была более заметна при возбуждении 450 нм на образцах, окрашенных акридиновым оранжевым, чем на образцах, окрашенных FM-143 или SYTO 9 (см. рис. 3). На изображениях, полученных при освещении образцов, хроококцидиопсис выглядит оранжево-красным из-за флуоресценции хлорофилла при ≈ 700 нм, в то время как SYTO 9 и акридиновый оранжевый выглядят зелеными из-за флуоресценции при 500 - 550 нм.
Рисунок 3. Спектр флуоресценции хлорофилла цианобактерий на мраморе.
Рисунок 4. Изображения DUV спектра B. Subtilis из SYTO 9 на мраморе (слева) и FM-143 на гипсе (справа).
Рисунок 5. Изображения спектра хлорофилла B. Subtilis на образцах: мрамор с SYTO9 (слева вверху), мрамор с AO (в центре вверху), мрамор с FM-143 (справа вверху), гипс с SYTO9 (слева внизу) и гипс с AO (внизу по центру).
Рисунок 6. Спектры флуоресценции хлорофилла и красителей на: мраморе с FM-143 (слева) и гипсе с FM-143 (справа).
Рисунок 7. Безметочные DUV изображения B. subtilis на мраморе: с триптофаном (слева) и с хлорофиллом (справа).
Рисунок 8. FM 1-43, окрашенный B. Subtilis на мраморе; спектральный анализ HDR с использованием возбуждения 450 нм с 430 - 730 нм. Ниже выделены спектральные диапазоны 430 - 510 нм (1. автофлуоресценция минералов), 540 - 585 нм (2. эмиссия FM1-43) и 675 - 720 нм (3. хлорофилл).
Рисунок 9. FM 1-43, окрашенный B. Subtilis на мраморе; спектральный анализ HDR с использованием 275 нм возбуждения от 430 - 730 нм. Ниже выделены спектральные диапазоны 430 - 510 нм (1. автофлуоресценция минералов), 540 - 585 нм (2. эмиссия FM1-43) и 675 - 720 нм (3. хлорофилл).
Обсуждение
Красители SYTO 9 и FM-143 давали идентифицируемые флуоресцентные сигналы, которые можно было отличить от хлорофилла на изображениях спектра хлорофилла. Легкость идентификации этих сигналов при возбуждении DUV была непостоянной, но при времени экспозиции 10 с и практически плоском поле зрения на образцах эти сигналы можно было отличить от флуоресценции минералов. В изображениях спектра хлорофилла, использующих возбуждение 450 нм, которые имеют тенденцию вызывать более сильную флуоресценцию минералов, чем возбуждение DUV, сигналы красителей часто были слабее, чем у хлорофилла, и лишь иногда достаточно локализованы, чтобы их можно было отличить от флуоресценции минералов (см. рис. 4b). На DUV-изображениях мрамора и гипса флуоресценция B. subtilis, окрашенного акридиновым оранжевым, не была идентифицирована. И гипс, и мрамор имели пик флуоресценции минералов при NUV-возбуждении, что делало сигналы всех красителей неидентифицируемыми на изображениях NUV-спектра, как и ожидалось. Для образцов гипса и мрамора, инокулированных B. subtilis, но не окрашенных, сигналы триптофановой автофлуоресценции бактерий B. subtilis были идентифицируемы. Сигналы автофлуоресценции хлорофилла от Chroococcidiopsis в тех же образцах также можно было идентифицировать, но они были слабее, чем сигналы автофлуоресценции триптофана от бактерий B. subtilis.
Заключение
Результаты, полученные с помощью пользовательской установки микроскопа Thorlabs/Cerna, демонстрируют, что характеристики флуоресценции окрашенных Bacillus subtilis и, более того, отдельных бактериальных клеток в целом, могут быть исследованы на нескольких эндолитических поверхностях с помощью одного микроскопа, камеры и источников возбуждения в DUV, NUV и видимом диапазонах. Взаимосвязь между спектрами флуоресценции красителей и конкретными эндолитическими/минеральными поверхностями может быть профилирована с помощью используемого здесь метода. Дальнейшая классификация пар минерал/краситель обогатит знания о поведении флуорофоров при DUV, NUV и видимом возбуждении и, возможно, даже предоставит обучающие данные для исследований в области астробиологии, в том числе для устройств внеземных миссий, использующих флуоресцентную визуализацию.
Компания INSCIENCE помогает своим заказчикам решать любые вопросы и потребности
по поставке оборудования на территории РФ
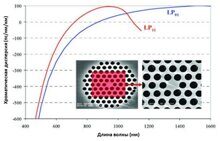
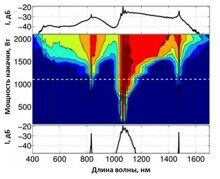
В статье описан метод генерации суперконтинуума, расширенного в видимый диапазон. За счет четырехволнового смешения накачка 1064 нм создает антистоксовы и стоксовы компоненты на 831 нм и 1478 нм. Фазовый синхронизм обеспечивается благодаря микроструктурированному мультимодальному волокну особой конструкции.
контакты
г. Санкт-Петербург, улица Савушкина 83, корп. 3