Пространственно-разрешенная регистрация переходных процессов времени жизни флуоресценции
Принцип работы
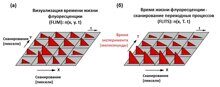
Получение визуализации времени жизни флуоресценции (FLIM) с использованием многомерного время-коррелированного счета фотонов (TCSPC) основано на растровом сканировании образца, детектировании одиночных фотонов излучаемого флуоресцентного света и построении распределения фотонов по координатам области сканирования x и y и времени прихода t фотонов после лазерных импульсов (рис.1).
Метод время жизни флуоресценции - сканирование переходных процессов (FLITS) сочетает использование многомерного TCSPC с линейным сканированием и позволяет осуществлять пространственно-разрешенную регистрацию временных переходных процессов (рис. 1). T – время, прошедшее после события, имеющего временную корреляцию с изменением времени жизни образца, например, начала стимуляции. X - расстояние вдоль линии одномерного пространственного сканирования.
Секвенсор модуля TCSPC начинает работать с момента стимуляции и помещает фотоны в последовательные блоки данных для временных интервалов вдоль оси T. Процесс записи можно сделать повторяющимся: образец периодически стимулируется, инициируется запись вдоль оси T, фотоны от нескольких периодов стимуляции накапливаются в соответствующих блоках до достижения желаемого соотношения сигнал/шум. Разрешение по T ограничено периодом строчной развертки – приблизительно 1 мс для широко используемых сканеров.
Рисунок 1 — (а) Построение распределения фотонов методом FLIM, (б) построение распределения фотонов методом FLITS.
Техническое решение
FLITS выполняется в режиме 'FIFO Imaging' модулей TCSPC Becker & Hickl. Синхронизация осуществляется обычным способом – через пиксельные, строчные и кадровые синхроимпульсы. Однако, в отличие от FLIM, кадровый синхроимпульс для FLITS поступает не от сканера, а от стимуляции образца (рис. 2).
Таким образом, модуль SPC регистрирует распределение фотонов n (x, T, t), координатами которого являются расстояние x вдоль сканируемой линии, время регистрации t фотона после лазерного импульса и переходное время T после стимуляции.
Рисунок 2 — Принцип регистрации эффектов переходного времени жизни методом линейного сканирования
Хлорофилловые переходные процессы
Для демонстрации метода FLITS исследуются хлорофилловые переходные процессы. При усилении освещения растения время жизни флуоресценции (и интенсивность) сначала увеличивается в течение нескольких миллисекунд или десятков миллисекунд. Соответствующее увеличение квантовой эффективности и времени жизни флуоресценции называется "фотохимическим переходом".
Через несколько секунд время жизни флуоресценции снова начинает уменьшаться и выходит на стационарный уровень через несколько десятков секунд. Это медленное снижение называется "нефотохимическим переходом".
Нефотохимический переходный процесс
Для регистрации хлорофилловых переходных процессов в травинке методом FLITS используется конфокальная сканирующая FLIM-система Becker & Hickl DCS-120. Запись начинается с генерации одного кадрового синхроимпульса. Через 180 мс включается возбуждающий лазер. Результат показан на рис. 3.
Горизонтальная координата - расстояние вдоль сканируемой линии, вертикальная координата - время T после кадрового синхроимпульса. Время t = 60 мс, число отсчетов по оси T и по оси X составляет 256. Таким образом, общее время регистрации составляет ~15,4 секунды. Заметно, что интенсивность и время жизни флуоресценции уменьшаются с увеличением времени освещения.
Рисунок 3 — FLITS-изображение нефотохимического хлорофиллового перехода. Горизонталь: Расстояние вдоль сканируемой линии X. По вертикали, снизу -вверх: время Т после начала стимуляции. Слева: визуализация интенсивности. Справа: визуализация времени жизни. Цвет обозначает время жизни (200 пс – 1 нс), от синего до красного. Внизу: кривая затухания в позиции курсора.
Подробно этот эффект показан на рис. 4. На нем представлены кривые затухания для трех выбранных пикселей строчной развертки для 0,5 с, 7,5 с и 13,4 с после включения лазера. Средние значения времени жизни tm составляют 560 пс, 385 пс и 311 пс соответственно. Заметны изменения в профилях распада.
Рисунок 4 — Кривые затухания для выбранного пикселя в пределах линии для 0,5 с, 7,5 с и 13,4 с после включения лазера
Фотохимический переход
Регистрация фотохимического перехода требует периодической стимуляции и сбора данных за несколько периодов. Сигнал включения лазера и кадровые часы генерировались платой генератора импульсов Becker & Hickl DDG-210. Период включения-выключения составил 1 с, время работы лазера в пределах периода – 200 мс. Всего накоплено 40 периодов. Каждое включение лазера инициирует фотохимический переход, в период выключения лазера лист частично восстанавливается, затем процесс повторяется.
Время сканирования t составляло 1 мс. В направлении Т было записано 256 строк, т.е. всего 256 мс. Лазер включается при T = 0 и выключается при T = 200 мс. Диапазон времени жизни 450 пс – 650 пс (от синего до красного).
Хотя изменение времени жизни менее выражено, чем для нефотохимического перехода, можно четко проследить его увеличение. Изменения особенно заметны в первые 10-20 мс после включения лазера.
Кривые распада и время жизни для выбранного пикселя в развертке и для двух точек на оси Т приведены на рис. 5. От T = 3 мс до T = 191 мс амплитудно-взвешенное время жизни увеличивается с 480 пс до 530 пс.
Рисунок 5 — Кривые затухания для выбранного пикселя (x=159) в пределах линии для T=3 мс и T=191 мс в фазах включения лазера. Подгонка по двойной экспоненте. Амплитудно-взвешенное время жизни увеличивается с 480 пс до 530 пс
Заключение
FLITS регистрирует переходные процессы времени жизни флуоресценции с одномерным пространственным разрешением с временным масштабом порядка одной миллисекунды. Данная методика может быть легко реализована в конфокальных или многофотонных лазерных сканирующих микроскопах при условии, что они способны выполнять быстрое построчное сканирование.
Методика применима как при одномоментной, так и при периодической стимуляции. При заданной скорости детектирования фотонов точность определения времени жизни при одномоментной стимуляции уменьшается с уменьшением ширины временного канала вдоль оси времени перехода. При периодической стимуляции точность зависит от общего времени регистрации. Таким образом, периодическая стимуляция является ключом к анализу переходных процессов с высоким разрешением. Потенциальные области применения FLITS – физиология растений, электрофизиология и визуализация ионов Ca++ в ткани нейронов.
Компания INSCIENCE является поставщиком научного оборудования для исследований флуоресценции
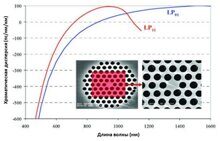
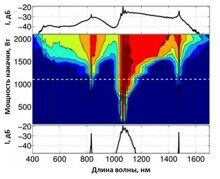
В статье описан метод генерации суперконтинуума, расширенного в видимый диапазон. За счет четырехволнового смешения накачка 1064 нм создает антистоксовы и стоксовы компоненты на 831 нм и 1478 нм. Фазовый синхронизм обеспечивается благодаря микроструктурированному мультимодальному волокну особой конструкции.
контакты
г. Санкт-Петербург, улица Савушкина 83, корп. 3