Диагностика опухолей кожи во время микрографической хирургии Мооса
Оптическая спектроскопия – это общий метод определения оптических свойств различных поверхностей, таких как коэффициент отражения и пропускание в области электромагнитных спектров. Диапазон измерения спектрометра зависит от области применения. Одной из этих областей может быть биомедицина. Оптическая спектроскопия предоставляет очень конкретную аналитическую информацию о неинвазивном веществе для ряда биологических образцов, часто в качестве дополнения к микроскопии (микоспектроскопии) или визуальному осмотру.
Диагностика опухолей кожи во время микрографической хирургии Мооса
Автоматическая визуализация и диагностика удаляемых образцов ткани во время онкологической хирургии – многообещающий подход для повышения эффективности самой современной хирургической процедуры. Во-первых, этот количественный подход может повысить эффективность хирургического вмешательства за счет устранения ошибок, связанных с субъективной оценкой гистопатологических срезов между наблюдателями. Во-вторых, мультимодальная спектральная гистопатология может применяться к срезам ткани, а также к тканевому блоку, что устраняет трудоемкие процедуры, необходимые для приготовления замороженных образцов, необходимых для гистопатологии.
Базальноклеточная карцинома составляет около 75% случаев рака кожи, и ежегодно в Великобритании диагностируется более 60 000 новых пациентов. Для агрессивных базалиом наиболее подходящим лечением считается микрографическая хирургия Мооса. Его основным недостатком является необходимость подготовки замороженных срезов и гистопатологического исследования всех удаляемых тканей, что является неавтоматизированным и трудоемким методом.
Чтобы сократить время сбора данных и сделать молекулярную спектроскопию пригодной для интраоперационного использования, исследовательская группа из Ноттингемского университета разработала новые методы выборочного отбора проб, основанные на мультимодальной спектральной визуализации. Команда сначала использовала автофлуоресцентную визуализацию тканей, которая имеет высокую чувствительность, высокую скорость и низкую специфичность, чтобы определить основные пространственные характеристики образца. Затем эта информация использовалась в автоматическом режиме для выбора и определения приоритетности точек отбора проб для рамановской спектроскопии.
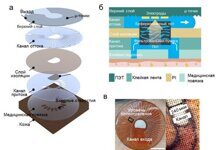
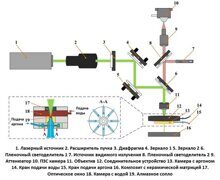
Спектры комбинационного рассеяния регистрировали с использованием специально созданного рамановского микроспектрометра (рисунок 1) на основе инвертированного оптического микроскопа (Eclipse-Ti, Nikon) с объективом 50×/0.55 (Leica), лазером с длиной волны 785 нм (Starbright XM, Torsana ), спектрограф (77200, Newport / Oriel), ПЗС-матрица глубокого обеднения с обратной засветкой (DU401A-BR-DD, Andor Technology) и автоматический столик для образцов (H107 Proscan II, Prior Scientific). Длина волны возбуждающего лазера была выбрана так, чтобы минимизировать возбуждение аутофлуоресценции ткани. Автофлуоресцентные изображения срезов ткани были измерены с использованием системы формирования изображения флуоресценции с широким полем, интегрированной в рамановский микроскоп; система состояла из ртутной лампы (Nikon), камеры CCD и флуоресцентных фильтров для коллагена (Semrock, DAPI-5060C-NTE-ZERO) и триптофана (Semrock FF310-Di01-25 × 36, FF01-292 / 27-25, FF01 -357 / 44-25).

Рисунок 1. Схематическое описание прибора
Сравнение мультимодальной спектральной визуализации и растровой сканирующей рамановской микроскопии представлено на рисунке 2. Эта стратегия выборки позволяет получить диагностическую точность, аналогичную растровой рамановской спектроскопии, но с резким уменьшением количества рамановских спектров и времени сбора данных. Точный диагноз может быть получен только с помощью спектров комбинационного рассеяния 500-1500 для образцов кожи размером 1×1 см2, полученных во время операции Мооса, как для срезов ткани (рисунок 3), так и для неразрезанных блоков ткани.
Для лабораторного прототипа время получения автофлуоресцентных изображений составляло 4 минуты, время интегрирования для каждого рамановского спектра составляло 2 секунды, обработка сегментации изображения с использованием стандартного ПК составляла 2 минуты. Используя эти цифры, время диагностики можно оценить в 20-60 минут, что даже на этой ранней стадии короче, чем гистопатология замороженных срезов, используемая в настоящее время, а это около 2 часов.
Эти результаты показывают потенциал мультимодальной спектральной гистопатологии для диагностики тканей во время онкологических операций. Это позволяет быстро и объективно определить, чисты ли слои ткани, удаленные хирургом, от опухоли.

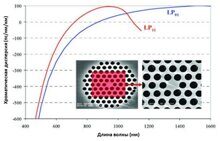
Рисунок 2. а) Соотношение широкополосных изображений интенсивности автофлуоресценции, соответствующих коллагену (исключение 377 нм / излучение 447 нм) и триптофану (исключение 292 нм / излучение 357 нм), анализировали с помощью алгоритма сегментации изображения. Сегменты, вызывающие интенсивность автофлуоресценции коллагена выше порогового значения, были классифицированы как дерма и исключены из рамановских измерений. Для остальных сегментов каждому сегменту было выделено пять точек выборки на основе алгоритма заполнения пробелов. б) Диагноз был получен только по 350 рамановским спектрам по сравнению с 40 000 для растрового сканирования. c) Гистопатология соседнего участка ткани (опухоль указана синими стрелками)

Рисунок 3. Диагностика базалиомы в тканях, удаленных во время операции Мооса (независимые пациенты): a-e) положительный, f-h) отрицательный. Количество спектров, используемых для диагностики, включено для каждого образца. Размерность шкалы: 2 мм
© Andor
Компания INSCIENCE помогает своим заказчикам решать любые вопросы и потребности по продукции Andor на территории РФ
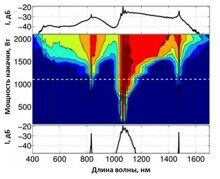
В статье описан метод генерации суперконтинуума, расширенного в видимый диапазон. За счет четырехволнового смешения накачка 1064 нм создает антистоксовы и стоксовы компоненты на 831 нм и 1478 нм. Фазовый синхронизм обеспечивается благодаря микроструктурированному мультимодальному волокну особой конструкции.
контакты
г. Санкт-Петербург, улица Савушкина 83, корп. 3