Характеристика свойств субхондральной кости человека с помощью спектроскопии в ближней инфракрасной области (БИК)
Аннотация
Дегенеративные заболевания суставов часто характеризуются изменениями свойств суставного хряща и субхондральной кости. Эти изменения часто связаны с толщиной субхондральной пластинки и морфологией трабекулярной кости. Таким образом, оценка целостности субхондральной кости может дать важные сведения для диагностики патологий суставов. В данном исследовании изучается потенциал оптической спектроскопии для характеристики свойств субхондральной кости человека. Образцы остеохондральной кости (n = 50 – количество образцов) были извлечены из коленного сустава трупа человека (n = 13) в четырех анатомических точках и подвергнуты БИК-спектроскопии(в ближней инфракрасной области). Затем образцы были исследованы с помощью микрокомпьютерной томографии для определения морфометрических характеристик субхондральной кости, включая: толщину пластинки (Sb.Th), толщину трабекул (Tb.Th), объемную долю (BV/TV) и индекс модели структуры (SMI). Связь между свойствами субхондральной кости и спектральными данными в 1-м (650 - 950 нм), 2-м (1100 - 1350 нм) и 3-м (1600-1870 нм) оптических окнах была исследована с помощью многомерного метода частичных наименьших квадратов (PLS) регрессии. Значимые корреляции (p < 0.0001) и относительно низкие ошибки прогнозирования были получены между спектральными данными в 1-м оптическом окне и Sb.Th (R2 = 92.3%, ошибка = 7.1%), Tb.Th (R2 = 88.4%, ошибка = 6.7%), BV/TV (R2 = 83%, ошибка = 9.8%) и SMI (R2 = 79.7%, ошибка = 10.8%). Таким образом, БИК-спектроскопия в 1-м тканевом оптическом окне способна характеризовать и оценивать свойства субхондральной кости и потенциально может быть адаптирована во время артроскопии.
Введение
Остеоартрит (ОА) — это заболевание синовиальных суставов, сопровождающееся болью, эрозией хряща, неподвижностью и общей дисфункцией суставов. Хотя обширные исследования патогенеза ОА были сосредоточены в основном на механизмах, связанных с разрушением суставного хряща, исследования предположили и продемонстрировали, что изменения свойств субхондральной кости могут быть ключевыми показателями в возникновении и прогрессировании ОА. Например, было показано, что утолщение субхондральной костной пластинки является важным клиническим проявлением у пациентов с ОА. Это объясняется тем, что здоровье вышележащего хряща зависит от механической целостности субхондральной кости, которая влияет на способность вышележащего хряща выдерживать нагрузку. Более того, утверждается, что некоторые типы первичного ОА у людей инициируются из субхондральной кости, а не являются заболеваниями, связанными с матриксом хряща. Кроме того, некоторые животные модели ОА свидетельствуют о том, что утолщение субхондральной кости происходит раньше, чем любые видимые изменения в хряще. Эти наблюдения подчеркивают важность определения целостности субхондральной кости для принятия решений во время интраоперационного лечения.
В настоящее время изменения субхондральной кости при развитии ОА выявляются и количественно оцениваются с помощью различных биомаркеров костеобразования и резорбции. Поскольку этот подход является косвенным и анатомически неспецифичным, клиническая диагностика изменений и ремоделирования субхондральной кости в значительной степени зависит от клинико-рентгенографического исследования, которое позволяет выявить склероз субхондральной кости и сужение суставного пространства. Однако этот метод ненадежен для выявления микроструктурных изменений субхондральной кости на ранних стадиях, которые могут предшествовать появлению поражений хряща. Более того, визуальная оценка во время артроскопической операции не дает информации о целостности субхондральной кости. Таким образом, существует необходимость в диагностических методах, способных проникать через хрящевой слой и выявлять изменения субхондральной кости при ОА, с возможностью применения in vivo. В данном исследовании мы предлагаем использовать ближнюю инфракрасную (БИК) спектроскопию и изучить ее возможности для выполнения этой задачи.
БИК-спектроскопия — это метод колебательной спектроскопии, чувствительный к молекулярным видам, содержащим конкретные связи (C-H, N-H, O-H и S-H), которые характеризуют фундаментальные структуры биологических материалов. Кроме того, уменьшенное поглощение фотонов в видимом-ИК спектральном диапазоне (650 - 2500 нм) обеспечивает более глубокое проникновение в ткани мягких тканей, что позволяет проводить оценку тканей мягких тканей in vivo. Видимая-ИК область спектра состоит из трех основных тканевых оптических окон: первое оптическое окно (650 - 950 нм), которое включает часть видимой и коротковолновой области, второе (1100 - 1350 нм) и третье оптические окна (1600 - 1870 нм), которые охватывают более длинноволновые диапазоны БИК.
Способность БИК-спектроскопии неразрушающе характеризовать соединительные ткани была ранее показана в литературе, и только одно исследование продемонстрировало способность этого оптического метода оценивать целостность субхондральной кости в животной модели ОА. Другие методы колебательной спектроскопии, такие как рамановская спектроскопия и спектроскопия среднего ИК-диапазона, также были предложены для оценки целостности кости. Спектроскопия среднего ИК-диапазона ограничена слабой глубиной проникновения в мягкие ткани (~10 мкм в перекрывающий суставной хрящ), а возможности пространственно-смещенной рамановской спектроскопии (SORS) для оценки целостности субхондральной кости через вышележащий хрящ не исследовались. Однако проникновение через мягкие ткани является уникальной особенностью БИК-спектроскопии, что делает ее идеальным методом для оценки глубоких хондральных и субхондральных тканей. В данном исследовании авторы изучали изучаем потенциал БИК-спектральных данных в трех оптических окнах для оценки свойств субхондральной кости человека, основываясь на гипотезе, что свет в различных оптических окнах проникает на разную глубину остеохондральных тканей и может предоставить диагностическую информацию, связанную со свойствами субхондральной кости. Чтобы проверить эту гипотезу, авторы исследовали связь между спектральным откликом образцов человеческой остеохондральной ткани в различных оптических окнах и свойствами субхондральной кости с помощью аналитического метода регрессии частичных наименьших квадратов (PLSR), дополненного спектральной предварительной обработкой. Параметры субхондральной кости, включая толщину субхондральной костной пластинки (Sb.T), толщину трабекулярной кости (Tb.T), объемную фракцию кости (BV/TV) и индекс модели структуры (SMI), были получены с помощью микрокомпьютерной томографии (микро-КТ).
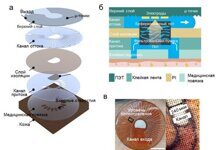
Рисунок 1. Обзор протокола исследования с указанием подготовки образцов и экспериментальных методик. Цилиндрические остеохондральные образцы (диам.=16 мм) были получены из коленных суставов человеческих трупов и разделены на квадранты. Один квадрант подвергался БИК-спектроскопии с помощью волоконно-оптического зонда (окно диам. = 2 мм), а затем получали изображение с помощью микротомографии. Объем интереса (VOI: 1×1.1×1,8 мм3) в области, подвергнутой БИК-спектроскопии, был выбран для проведения сегментации изображений с целью получения микроструктурных свойств субхондральной кости
Методика
Подготовка образцов. Цилиндрические остеохондральные образцы (n = 50, диам. = 16 мм) были вырезаны из коленных суставов человеческих трупов (N = 13, 12 мужчин, 1 женщина; 29 - 76 лет, средний возраст = 53. 5) без известных заболеваний суставов в четырех анатомических точках, а именно: латеральный мыщелок бедра (FLC, n = 12), бедренная борозда (FG, n = 12), медиальное плато большеберцовой кости (TMP, n = 13) и латеральное плато большеберцовой кости (TLP, n = 13). Два образца (каждый из FLC и FG) были исключены из-за почти полной потери хряща. Информированное согласие не было получено, поскольку образцы были получены от человеческих трупов. Образцы были разделены на квадранты, которые подвергались разным протоколам испытаний, в данном исследовании использовался только один из квадрантов (рис. 1).
Коленные суставы были получены из Центральной больницы Ювяскюля, Финляндия в соответствии с этическим разрешением Национального управления по медицинским делам, Хельсинки, Финляндия (разрешение 1781/32/200/01). Эксперимент и протоколы были выполнены в соответствии с соответствующими руководствами и правилами вышеупомянутого органа. После экстракции образцы погружали в фосфатно-буферный солевой раствор (PBS), содержащий ингибиторы протеолитических ферментов (этилендиаминтетрауксусная кислота дегидрат - EDTA; Merck, Darmstadt, Germany) и бензамидин HCl (Sigma, St. Louis, MO, USA), а затем замораживали. Перед экспериментами образцы размораживали и погружали в PBS, дополненный ингибиторами протеолитических ферментов, на протяжении всего исследования. Образцы размораживали только перед тестированием, чтобы минимизировать количество циклов замораживания-оттаивания.
Спектроскопия в ближней инфракрасной области (БИК). Диффузно-отражательная БИК-спектроскопия образцов проводилась с использованием спектрометра Avantes (длина волны 200 - 2500 нм, AvaSpec-ULS2048XL, Avantes BW, Apeldoorn, Нидерланды) и источника света (длина волны 360 - 2500 нм, мощность 5 Вт, оптическая мощность 239 мкВт в 600 мкм волокне, Avantes BW, Apeldoorn, Нидерланды). Спектрометр оснащен изготовленным на заказ волоконно-оптическим зондом (диам. = 5 мм), состоящим из семи волокон (диам. волокна = 600 мкм) в пределах центрального окна (диам. = 2 мм). Шесть волокон использовались для передачи БИК-излучения, а центральное волокно - для сбора диффузно отраженного света от образца. Сбор данных и мониторинг осуществлялись на персональном компьютере с программным обеспечением Avasoft 8.0 (Avantes BW, Апелдорн, Нидерланды). Перед получением спектра от образцов, темные спектры были собраны с выключенным источником света для устранения факторов окружающей среды, таких как рассеянный свет. Впоследствии эталонный спектр был получен от 99% эталона отражения, при этом волоконно-оптический зонд был перпендикулярен и находился в контакте с эталоном отражения. Спектр поглощения вычислялся из диффузного, темного и эталонного спектров. Для каждого образца проводилось три спектральных измерения, с перестановкой зонда перед каждым измерением. Каждое спектральное измерение состояло из 10 совмещенных сканирований, а окончательный спектр рассчитывался как среднее значение трех повторений. Также было обеспечено проведение микротомографического анализа в той области каждого образца, которая подвергалась БИК-спектроскопии.
Микротомографическая характеристика свойств субхондральной кости человека. После БИК-измерений образцы были исследованы с помощью конусно-лучевого микротомографа высокого разрешения (Skyscan 1172, Bruker micro-CT, Kontich, Бельгия) с изотропным размером вокселя 12.5 мкм и алюминиевым фильтром толщиной 0.5 мм. Напряжение рентгеновской трубки было установлено на 100 кВ, а сила тока - 100 мкА. Рентгеновские проекции были получены при шаге вращения 0.4° с временем экспозиции 316 мс. Изображения поперечного сечения реконструировались с использованием модифицированного алгоритма конусно-лучевого сканирования Фельдкампа (программное обеспечение NRecon, v.1.6.2.0, Skyscan, Bruker micro-CT, Kontich, Бельгия). Реконструированные данные микротомографии сначала импортировались в программное обеспечение Mimics (v.19, Materialise, Бельгия) для визуализации трехмерной (3D) геометрии остеохондральных образцов и сегментации.
Чтобы отличить костную ткань от хряща, все реконструированные полутоновые изображения были сегментированы с использованием фиксированного глобального порогового значения, определяемого визуальным осмотром результата сегментации. Затем в субхондральной кости, в области образца, где были получены спектральные измерения, был размещен интересующий объект (VOI) размером 1.0×1.1×1.8 мм3 (рис. 1). Затем эти VOI, содержащие субхондральную пластинку и субхондральную трабекулярную кость, были вручную разделены на сегменты двумя независимыми исследователями с помощью инструмента Mimics, основанного на контурах, чтобы разграничить эти два компонента (рис. 1). Субхондральная пластинка и трабекулярная кость были вручную сегментированы на расстоянии нескольких вокселей от эндокортикальной границы с использованием ранее описанного критерия, основанного на размере внутрикортикальных пор. Согласно этому критерию, эндокортикальная граница разделяет пору в случае крупных пор, тогда как пора включалась в область субхондральной пластинки, если размер поры был менее чем в два раза больше среднего размера пор в этой области или если размер поры был меньше, чем расстояние от поры до эндостальной (т.е. границы между костью и костным мозгом).
Затем сегментированные пластинки субхондральной кости и маски трабекулярной кости экспортировались с помощью программного обеспечения seg3D. Затем с помощью программного обеспечения CTAn (Skyscan, v.1.13, Bruker micro-CT, Kontich, Бельгия) были рассчитаны трехмерные (3D) морфометрические параметры субхондральной кости в соответствии с рекомендациями Американского общества по исследованию костей и минералов (ASBMR). Полученные 3D морфометрические параметры включают: толщину субхондральной пластинки (Sb.T); толщину трабекул (Tb.T), описывающую среднюю толщину трабекул; объемную фракцию трабекулярной кости (BV/TV), описывающую отношение объема кости к объему ткани; и индекс структурной модели (SMI), количественную оценку структуры трабекулярной кости как стержневой или пластинчатой. Параметры субхондральной кости определялись по среднему значению результатов сегментации независимых исследователей. Поскольку во время сверления возможно застревание смещенных частиц трабекулярной кости в костном мозге извлеченных остеохондральных пробок, для минимизации потенциального влияния артефактов костных частиц на морфометрические параметры анализировалась меньшая область VOI в центральной части каждого образца.
Оценка целостности хряща. Целостность суставного хряща оценивали гистологически по окрашенным Сафранином-О срезам ткани, полученным из образцов. Целостность ткани оценивалась тремя независимыми экспертами с использованием традиционной системы оценок Манкина. Образцы были закодированы вслепую, и каждый эксперт оценивал по три среза на образец. Итоговый балл получали как среднее значение оценок всех экспертов, округленное до ближайшего целого числа. Несмотря на то, что в данном исследовании использовались трупные суставы человека без известных заболеваний суставов, некоторые из образцов имели признаки дегенерации, возможно, вследствие старения. Для оценки взаимосвязи между целостностью хряща и свойствами субхондральной кости образцы были разделены на две группы: в первую группу (Класс 1) вошли образцы с показателем Манкина < 4, а во вторую (Класс 2) - образцы с показателем Манкина > 4. В контексте данного исследования "Класс 1" представляет нормальные образцы и образцы с "ранней" стадией дегенерации, а "Класс 2" - образцы с "легкой и поздней" дегенерацией.
Статистическая оценка. Статистический анализ морфологических параметров субхондральной кости проводили в программе Graphpad Prism (версия 5.0). Данные выражали как среднее±95% ДИ (доверительный интервал). Тест на соответствие норме был проведен для образцов, полученных из каждого анатомического места, с помощью теста D'Agostino и Pearson omnibus normality test, и был пройден для всех параметров субхондральной кости, за исключением BV/TV. Таким образом, разница между образцами из каждой анатомической локализации сравнивалась с помощью одностороннего ANOVA, p-значение менее 0.05 считалось статистически значимым. Для сравнения различий в BV/TV между различными анатомическими локализациями использовался непараметрический статистический метод Крускала-Уоллиса. Различия в параметрах субхондральной кости между двумя группами, определенными на основании оценки по шкале Манкина (класс 1 и 2), проводились с помощью t-теста. В случае несоответствия нормам применялся непараметрический тест Манна-Уитни.
Многомерный анализ: Регрессия методом частичных наименьших квадратов. Спектральные данные образцов (предикторы/зависимые переменные) были соотнесены с эталонными свойствами субхондральной кости (независимые переменные) с помощью регрессии частичных наименьших квадратов (PLSR). Этот метод билинейной регрессии извлекает факторы из предикторов (данных БИК) и регрессирует их на опорную переменную (свойства субхондральной кости), причем факторы формируются на основе максимизации показателя ковариации между зависимыми и независимыми переменными. Этот метод является более эффективным, чем другие многомерные методы, такие как регрессия главных компонент и множественная линейная регрессия, для анализа спектральных данных. Разработанные регрессионные (калибровочные) модели затем проверяются для получения точности и эффективности каждой модели при использовании для прогнозирования эталонных переменных по предикторам неизвестных образцов. В целом, знание качеств образца (т.е. эталонных свойств) вместе со спектральными данными используется для получения эмпирической модели прогнозирования.
Перед проведением PLSR-анализа нелинейности, например, возникающие из-за вариаций рассеяния света в спектроскопии отражения, часто корректируются/линеаризуются с помощью алгоритмов предварительной обработки, включая мультипликативную коррекцию рассеяния (MSC) и предварительную обработку производных. Чтобы исследовать потенциал БИК-спектроскопии для оценки целостности субхондральной кости, данные из трех оптических окон ткани рассматривались в анализе по отдельности. Каждая область была отдельно предварительно обработана и соотнесена с морфологическими свойствами субхондральной кости образцов с помощью алгоритма PLSR с одной y-переменной (PLS1). Метод k-кратной (k=10) перекрестной валидации использовался в процессе валидации для определения оптимального количества коэффициентов PLSR для каждой модели, а также для оценки эффективности калибровочных моделей. Для выбора наилучшей модели при потенциальной минимизации недо- и переподгонки оптимальный выбор модели был основан на минимизации числа компонентов PLSR и среднеквадратичной ошибки перекрестной валидации (RMSECV) при максимизации коэффициента детерминации (R2). Многомерный анализ проводили с использованием MATLAB R2016b (Natick, MA, USA).
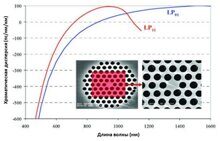
Рисунок 2. Представленные 1-я производная БИК-спектров образцов из различных анатомических локализаций с выделением (a) 1-го (OW 1), (b) 2-го (OW 2) и 3-го (OW 3) оптических окон. Вид крупным планом области OW 1 (c) показывает изменение спектра в зависимости от анатомического расположения, что соответствует тенденции различий в свойствах субхондральной кости между FLC, TLP и TMP. [FG = бедренная борозда; FLC = латеральный мыщелок бедра; TLP = латеральное плато большеберцовой кости; TMP = медиальное плато большеберцовой кости]
Результаты
Репрезентативные БИК-спектры образцов из различных анатомических мест в пределах трех оптических окон (рис. 2a,b) показывают вариации в 1-м оптическом окне, соответствующие свойствам субхондральной кости (рис. 2c), что подчеркивается в распределении параметров для каждого анатомического места (рис. 3).
Рисунок 3. Графики, показывающие сравнение морфометрических параметров субхондральной кости из различных анатомических мест коленного сустава человека, демонстрирующие различия в (а) толщине субхондральной пластинки (Sb.T), (б) толщине трабекул (Tb.T), (в) объемной фракции кости (BV/TV) и (г) индексе модели структуры (SMI). Значения - среднее ± 95% ДИ, **p < 0.05, *p > 0.05 и † p=0.117
Таблица 1. Статистическое сравнение параметров субхондральной кости из различных анатомических локализаций. Подчеркнутые тексты указывают на результаты непараметрического теста Манна-Уитни
Статистически значимые различия (p < 0.0001) наблюдались в показателях Sb.T, Tb.T и BV/TV образцов из различных анатомических областей (рис. 3a-c), причем образцы из медиального плато большеберцовой кости (TMP) показали более высокие значения, чем образцы из других областей. Сравнение параметров субхондральной кости из различных анатомических мест с помощью t-теста и непараметрического теста Манна-Уитни показало различные уровни статистической значимости (Таблица 1). Тем не менее, значимых различий (p = 0.117) между SMI образцов из разных анатомических локализаций не наблюдалось (рис. 3d). Следует отметить, что, несмотря на постменопаузу у женщины (возраст = 74 года), морфометрические характеристики субхондральной кости, полученные от нее, не имеют значительных отклонений от средних морфометрических параметров всей группы.
Оценка по шкале Манкина образцов варьировала от 1 до 9, при этом следующие значения представлены как средние (нижний и верхний 95% ДИ): FG, 2.33 (1.55, 3.12); FLC, 2.1 (1.66, 2.51); TLP, 3.2 (1.92, 4.38); TMP, 3.5 ± (2.13, 4.95). Образцы в "классе 2" (оценка по Манкину > 4, т.е. образцы с легкой и развитой дегенерацией) показали значительно более высокий Sb.T (0.36 ± 0.06 мм, p = 0.03), чем образцы в "классе 1" (оценка по Манкину < 4, т.е. нормальные и образцы с ранней дегенерацией, 0.29 ± 0.03 мм, рис. 4a). Однако статистически значимых различий в показателях Tb.T (p = 0.059, рис. 4b) и BV/TV (p = 0.411, рис. 4c) между группами не наблюдалось. Статистическое сравнение по уровню дегенерации для SMI не проводилось из-за отсутствия статистически значимых различий между образцами из разных анатомических областей.
Рисунок 4. Бокс-схема, показывающая сравнение морфометрических параметров субхондральной кости образцов, сгруппированных в соответствии с целостностью хряща, оцененной по баллу Манкина. Статистически значимое различие в толщине субхондральной пластинки, Sb.T (a), наблюдалось между образцами "класса 1" (оценка по шкале Манкина: < 4, ранняя стадия дегенерации) и "класса 2" (оценка по шкале Манкина: > 4, глубокая дегенерация). Между образцами обеих групп не наблюдалось существенной разницы в толщине трабекул, Tb.T (b), и объемной фракции кости, BV/TV (c)
Взаимосвязи между спектральными данными и параметрами субхондральной кости были оптимизированы с помощью предварительной обработки по второй производной (Таблица 2) для устранения вариаций базовой линии. Спектральные данные из 1-го оптического окна ткани были признаны оптимальными для оценки параметров субхондральной кости (табл. 2), при этом были получены сильные корреляции (R2) и низкие относительные ошибки между спектрально-прогнозируемыми и измеренными параметрами (рис. 5 и 6). Это говорит о том, что в отличие от 2-го и 3-го оптических окон, спектральные данные в 1-м оптическом окне испытывают минимальные помехи со стороны вышележащего хрящевого массива.
Таблица 2. Оценка связи между спектральными данными в различных оптических окнах и параметрами субхондральной кости с помощью многомерного анализа. [N = количество компонентов PLS; R2 = коэффициент детерминации; RMSECV = корневая средняя квадратическая ошибка перекрестной валидации; RMSEC = корневая средняя квадратичная ошибка калибровки. Оба параметра ошибки оцениваются относительно диапазона эталонных данных]. R2 для BV/TV был рассчитан непараметрическим методом (Спирмена) из-за отсутствия нормальности. *Оптимальное тканевое оптическое окно.
Рисунок 5. Взаимосвязь между спектрально измеренной и спрогнозированной (a) толщиной субхондральной пластины, Sb.T, и (c) толщиной трабекул, Tb.T, образцов человеческого остеохондроза. Графики остатков для (b) Sb.T и (d) Tb.T показывают относительную процентную ошибку прогноза для каждого образца относительно диапазона.
Рисунок 6. Взаимосвязь между спектрально измеренными и спрогнозированными (a) объемной долей костной ткани, BV/TV, и (c) индексом модели структуры, SMI, образцов остеохондральной ткани человека. Графики остатков для BV/TV (b) и SMI (d) показывают относительную процентную ошибку прогнозирования для каждого образца относительно диапазона.
Связь между измеренными и спектрально спрогнозированными параметрами субхондральной кости в первом тканевом оптическом окне представлена на графиках разброса и остатков на рис. 5 и 6. Графики остатков показывают процентную ошибку прогнозирования для всех образцов относительно диапазона.
Обсуждение
Исследователи оценили оцениваем возможности оптической спектроскопии в конкретных БИК-областях спектра (тканевые оптические окна) для неразрушающей оценки свойств субхондральной кости человека. Оптимальная спектральная область для оценки свойств субхондральной кости, т.е. 1-е оптическое окно, согласуется с результатами демонстрации способность оптической спектроскопии прогнозировать свойства субхондральной кости в доклинических моделях ОА у крыс. Результаты данного исследования позволяют предположить, что спектральные данные в различных оптических окнах кодируют информацию, связанную со свойствами хряща и субхондральной кости. Более того, результаты показывают, что зависящее от длины волны проникновение света в остеохондральные образцы играет важную роль во взаимосвязи между оптическим откликом и свойствами субхондральной кости. Это видно из высокой корреляции (Таблица 2), полученной с данными в 1-м оптическом окне, в котором свет проникает глубже глубже, чем свет в других окнах. Это соответствует литературным данным и подтверждает гипотезу о том, что свет в различных оптических окнах обладает различной глубиной проникновения в остеохондральные ткани, что может дать информацию о свойствах субхондральной кости. Хотя инфракрасная спектроскопия с преобразованием Фурье (FTIR) способна оценить хрупкость кости и риск перелома, что требует биопсии кости, данное исследование демонстрирует расширение возможностей родственного оптического метода, БИК-спектроскопии, для неразрушающей оценки качества субхондральной кости.
На основании полученных результатов и данных литературы о способности БИК-спектроскопии отслеживать различные уровни изменений в хряще и субхондральной кости, связанных с ОА, авторы пришли к выводу, что этот оптический метод способен одновременно характеризовать целостность суставного хряща и субхондральной кости в здоровых и больных суставах человека. Это представляет значительный потенциал для дополнения обычной артроскопии в клинической оценке дефектных суставов, например, для определения тяжести и степени старения суставной ткани, что позволяет оптимально диагностировать состояние сустава и поддерживать обоснованное решение о лечении.
Значительные различия в Sb.T, Tb.T и BV/TV образцов из разных анатомических локализаций (рис. 3a,b и d), вероятно, обусловлены анатомическими различиями в нагрузке на сустав. Например, медиальный отдел более подвержен дегенерации; таким образом, это может быть возможным объяснением постоянно более высоких параметров Sb.T, Tb.T и BV/TV у образцов из ТМП. Кроме того, образцы из этого анатомического места имели более высокий балл по шкале Манкина, чем другие места, что указывает на более высокий уровень старения хрящевой ткани. Отсутствие статистически значимых различий в SMI образцов из разных анатомических локализаций, вероятно, связано с чувствительностью этого параметра к выбранной микротомограмме VOI, которая, возможно, не охватывала всю трабекулу, поскольку SMI измеряет пластинчатую или стержневую геометрию трабекулярных структур. Стоит отметить, что поскольку выбранный микротомограф VOI мог не полностью покрывать трабекулы в пределах своей граничной области (т.е. некоторая часть трабекул могла быть "вырезана"), полученный SMI мог быть ненадежно оценен по спектрам.
Значительное различие в Sb.T, наблюдаемое между образцами класса 1 и класса 2, т.е. между ранней и развитой дегенерацией хряща (рис. 4a), подтверждает сильную взаимосвязь и взаимодействие между целостностью хряща и толщиной субхондральной пластинки. В этой взаимосвязи дегенерация хряща на ранней стадии приводит к изменению механических свойств субхондральной костной пластинки, что приводит к увеличению толщины пластинки из-за повышенной кристалличности минералов и неиерархической внутрифибриллярной минерализации, что в конечном итоге приводит к дальнейшему повреждению хряща. Этот вывод согласуется с результатами существующих исследований, в которых увеличение толщины пластин наблюдалось в суставах человека и кролика при ОА; хотя в суставах, использованных в данном исследовании, наблюдались признаки дегенерации хряща, а не клинически диагностированный ОА. Более того, увеличение толщины пластин при общей дегенерации хряща соответствует склерозу костей при ОА как у людей, так и у приматов и морских свинок. Это говорит о модификации костного метаболизма, который при ОА у человека характеризуется повышенным метаболизмом коллагена отменной кости.
И наоборот, между образцами класса 1 и класса 2 не наблюдалось значительных различий в показателях Tb.T (рис. 4b) и BV/TV (рис. 4c). Хотя это противоречит результатам Bobinac et al., где в образцах суставов человека с ОА наблюдалось увеличение Tb.T и BV/TV, эти результаты согласуются с данными Fahlgren et al., где было высказано предположение, что первый ответ костной ткани на ухудшение состояния сустава происходит в субхондральной костной пластинке, а не в нижележащей трабекулярной кости. Более того, принято считать, что субхондральная пластинка и трабекулярная кость реагируют по-разному и должны рассматриваться как отдельные структуры. Таким образом, это позволяет предположить, что характер изменения субхондральной кости в процессе старения может не соответствовать линейной тенденции дегенерации суставного хряща. Другими словами, визуальная характеристика выраженности степени хрящевой дегенерации не дает достаточной информации для оценки основного состояния субхондральной кости.
Как упоминалось ранее, у испытуемых не было известных заболеваний суставов, однако в некоторых образцах наблюдались признаки дегенерации, вероятно, вызванные старением. Известно, что в процессе старения в тканях суставов происходят структурные и композиционные изменения, включая фибрилляцию поверхности хряща, изменение оборота костной ткани и увеличение плотности субхондральной кости, что предрасполагает сустав к развитию ОА. В данном исследовании различие между уровнями дегенерации суставов было основано на целостности хряща, оцененной гистологически по шкале Манкина, при этом более дегенерированные образцы демонстрировали значительно большую толщину субхондральной пластинки, что связано с изменением оборота костной ткани. Тем не менее, мы отмечаем, что данное исследование направлено на изучение возможностей БИК-спектроскопии для определения целостности субхондральной кости человека, с потенциальным применением для диагностики изменений в суставе, связанных с ОА, во время артроскопии.
Значительно линейная связь (Таблица 1) между прогнозируемыми и измеренными морфометрическими параметрами субхондральной кости (рис. 5 и 6), полученными с помощью данных 1-го оптического окна, возможно, обусловлена сочетанием поглощения и рассеяния глубоко проникающего света субхондральной костью. Спектральное поглощение, наблюдаемое в БИК-спектре биологических материалов, происходит в основном за счет C-H, N-H, O-H и S-H связей, а также указывает на микро- и макроскопические изменения в их структуре. Таким образом, БИК-спектр остеохондральных образцов содержит скрытую информацию о физических и структурных характеристиках как суставного хряща, так и лежащей под ним субхондральной кости. Таким образом, применение спектральных данных из определенных оптических окон ткани позволяет извлечь информацию, зависящую от глубины, поскольку БИК-свет способен проникать в биологическую ткань на глубину около 8.5 мм. Спектральные поглощения, наблюдаемые в OW 1, обусловлены 3-м обертоном C-H и N-H колебаний, связанных с основными колебаниями амидов в средней ИК-области спектра, и, вероятно, указывают на содержание коллагена в матрице. Следует отметить, что полосы в БИК-области относительно широкие и часто перекрываются, что затрудняет оценку конкретных пиков из-за их ангармонической природы. Это затрудняет разделение вклада коллагена в хряще и субхондральной кости. Однако, поскольку свет в этой области проникает глубже, эти колебания, скорее всего, исходят от коллагена субхондральной кости, основного компонента внеклеточного матрикса кости.
Помимо проникновения и рассеивания света внутри субхондральной кости, часть света рассеивается от границы раздела хрящ-кость и, вероятно, является функцией шероховатости границы раздела. Таким образом, этот параметр потенциально может предоставить информацию о субхондральных остеофитах и может быть индикатором ОА, который вызывает ремоделирование субхондральной кости и образование остеофитов. Хотя в данном исследовании это не изучалось, метод может быть расширен для выявления патологических показателей ОА. Плохая корреляция, полученная с данными 2-го и 3-го оптических окон, объясняется значительным поглощением света в хрящевой матрице, поскольку спектральные измерения проводились через суставной хрящ, что значительно уменьшает количество света БИК, достигающего субхондральной кости.
Потенциальным ограничением настоящего исследования является то, что точное взаимодействие и глубина проникновения света в различных оптических окнах в хрящ и субхондральную кость до конца не изучены. Кроме того, не до конца понятно взаимодействие света с тремя субхондральными минерализованными тканями, а именно кальцифицированным хрящом, субхондральной кортикальной костью и субхондральной трабекулярной костью, которые отличаются морфологически, физиологически и механически. Это потребует вычислительного моделирования переноса света и взаимодействия с мягкими и твердыми тканями, что выходит за рамки данного исследования. Тем не менее, данное исследование представляет собой значительный вклад в развитие знаний, которые могут способствовать неразрушающей оценке состояния субхондральной кости в режиме реального времени. Кроме того, в данном исследовании не было учтено влияние костного мозга и его вклад в спектры остеохондральных образцов. Этот эффект, может быть полностью учтен только с помощью моделирования, о чем говорилось выше.
Данное исследование впервые продемонстрировало потенциал БИК-спектроскопии для оценки свойств субхондральной кости человека как средства быстрой и неразрушающей оценки целостности субхондральной кости при ОА. Хотя этот подход был ранее продемонстрирован на крысиных моделях ОА, авторы представили шаг к клинической адаптации этой оптической техники для артроскопической оценки целостности субхондральной кости. Сочетая спектральные данные в 1-м тканевом оптическом окне с произведенной предварительной обработкой и многомерным анализом, БИК-спектроскопия способна поддерживать in vivo количественную оценку изменений субхондральной кости в дефектных суставах. В заключении следует отметить, что данный оптический метод имеет потенциал для облегчения неразрушающей артроскопической оценки в реальном времени изменений субхондральной кости, происходящих в процессе развития ОА.
Компания INSCIENCE помогает своим заказчикам решать любые вопросы и потребности
по поставке оборудования на территории РФ
В статье описан метод генерации суперконтинуума, расширенного в видимый диапазон. За счет четырехволнового смешения накачка 1064 нм создает антистоксовы и стоксовы компоненты на 831 нм и 1478 нм. Фазовый синхронизм обеспечивается благодаря микроструктурированному мультимодальному волокну особой конструкции.
контакты
г. Санкт-Петербург, улица Савушкина 83, корп. 3